فلزات
فلزات: درک مفهوم فلزات و الکترونهای رسانش در فیزیک
در علم فیزیک، فلزات از جمله موادی هستند که به دلیل ساختار الکترونیکی خود ویژگیهای خاصی مانند رسانایی الکتریکی بالا از خود نشان میدهند. برای درک دقیقتر این ویژگیها و قوانین حاکم بر رفتار فلزات، باید به مفاهیمی همچون انرژی فرمی، تعداد الکترونهای رسانش و چگالی حالتهای انرژی بپردازیم. این مقاله به بررسی جامع این مفاهیم و روابط مهم فیزیکی آنها میپردازد و مثالهایی کاربردی ارائه میدهد تا درک آسانتر شود.
الکترونهای رسانش و انرژی فرمی
الکترونهای رسانش چیست؟ در فلزات، نوار انرژی بالاترین سطحی است که الکترونها در آن قرار دارند. اگر این نوار انرژی بهطور کامل پر نشده باشد، فلز به راحتی میتواند الکترونهای خود را به حرکت درآورد که این ویژگی مهم برای رسانش الکتریکی است. به این الکترونهای موجود در نوار نیمهپر، الکترونهای رسانش گفته میشود.
تعداد الکترونهای رسانش
تعداد الکترونهای رسانش در یک نمونه فلزی با تعداد اتمهای موجود در نمونه و تعداد الکترونهای ظرفیت هر اتم تعیین میشود. فرمول کلی به این شکل است:
تعداد الکترونهای رسانش=تعداد اتمهای نمونه×تعداد الکترونهای ظرفیت هر اتم
برای مثال، اگر یک نمونه فلزی دارای ۱۰۰۰ اتم باشد و هر اتم ۲ الکترون ظرفیت داشته باشد، تعداد کل الکترونهای رسانش ۲۰۰۰ عدد خواهد بود.
محاسبه تعداد اتمهای موجود در یک نمونه
برای محاسبه تعداد اتمهای موجود در یک نمونه فلزی، میتوان از رابطه زیر استفاده کرد:
تعداد اتمها در نمونه=جرم اتمی یا مولارجرم نمونه×![]()
که در آن:
جرم نمونه: جرم کلی نمونه
جرم مولار: جرم مولی عنصر در گرم/مول
![]() : عدد آووگادرو (
: عدد آووگادرو (![]() )
)
چگالی عددی الکترونهای رسانش
چگالی عددی الکترونهای رسانش در نمونه برابر است با تعداد الکترونهای رسانش تقسیم بر حجم نمونه:
![]()
این چگالی به ما اطلاعات مفیدی درباره تعداد الکترونهای موجود برای رسانایی در واحد حجم میدهد و یکی از فاکتورهای تعیینکننده ویژگیهای الکتریکی و حرارتی فلزات است.
چگالی حالتها 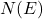
چگالی حالتها یا ![]() به تعداد سطحهای انرژی موجود در واحد حجم و واحد انرژی برای الکترونها در یک نمونه اشاره دارد. رابطه چگالی حالتها به این صورت بیان میشود:
به تعداد سطحهای انرژی موجود در واحد حجم و واحد انرژی برای الکترونها در یک نمونه اشاره دارد. رابطه چگالی حالتها به این صورت بیان میشود:
![]()
که در آن:
![]() : جرم الکترون (
: جرم الکترون (![]() کیلوگرم)
کیلوگرم)
![]() : ثابت پلانک (
: ثابت پلانک (![]() ژول-ثانیه)
ژول-ثانیه)
![]() : انرژی الکترون در ژول
: انرژی الکترون در ژول
برای تبدیل این رابطه به واحد الکترونولت و چگالی حالتها به ![]() ، باید رابطه را در
، باید رابطه را در ![]() ضرب کنیم که
ضرب کنیم که ![]() برابر با
برابر با ![]() کولن است.
کولن است.
مثالی از چگالی حالتها
فرض کنید میخواهیم چگالی حالتها را برای انرژی معین ![]() محاسبه کنیم. به عنوان مثال، اگر
محاسبه کنیم. به عنوان مثال، اگر ![]() eV، میتوانیم رابطه بالا را برای محاسبه تعداد حالتهای موجود در این انرژی خاص استفاده کنیم.
eV، میتوانیم رابطه بالا را برای محاسبه تعداد حالتهای موجود در این انرژی خاص استفاده کنیم.
احتمال اشغال یک حالت انرژی 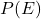
هر سطح انرژی در فلز میتواند توسط یک الکترون اشغال شود. احتمال اینکه یک حالت انرژی خاص توسط الکترون اشغال شود با رابطه زیر محاسبه میشود:
![]()
که در آن:
![]() : انرژی سطح مورد نظر
: انرژی سطح مورد نظر
![]() : انرژی فرمی
: انرژی فرمی
![]() : ثابت بولتزمن (
: ثابت بولتزمن (![]() ژول بر کلوین)
ژول بر کلوین)
![]() : دما در کلوین
: دما در کلوین
این رابطه که به عنوان توزیع فرمی-دیراک شناخته میشود، نشان میدهد که در دماهای پایین (نزدیک به صفر مطلق)، احتمال اشغال حالتهایی که انرژی کمتری از ![]() دارند بسیار بالا و احتمال اشغال حالتهایی که انرژی بیشتری از
دارند بسیار بالا و احتمال اشغال حالتهایی که انرژی بیشتری از ![]() دارند بسیار پایین است.
دارند بسیار پایین است.
چگالی حالت های اشغال شده 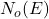
چگالی حالتهای اشغال شده ![]() از حاصلضرب چگالی حالتها
از حاصلضرب چگالی حالتها ![]() و احتمال اشغال
و احتمال اشغال ![]() به دست میآید:
به دست میآید:
![]()
این رابطه تعداد حالتهای انرژی را که توسط الکترونها در یک دمای خاص اشغال شدهاند توصیف میکند.
اهمیت انرژی فرمی
انرژی فرمی ![]() معیاری برای تعیین سطح انرژی بالاترین الکترونها در دمای صفر کلوین است. این انرژی نقشی کلیدی در تعیین ویژگیهای الکتریکی و حرارتی فلزات ایفا میکند. برای محاسبه انرژی فرمی یک فلز میتوان از رابطه زیر استفاده کرد:
معیاری برای تعیین سطح انرژی بالاترین الکترونها در دمای صفر کلوین است. این انرژی نقشی کلیدی در تعیین ویژگیهای الکتریکی و حرارتی فلزات ایفا میکند. برای محاسبه انرژی فرمی یک فلز میتوان از رابطه زیر استفاده کرد:
![]()
این رابطه به ما اجازه میدهد تا انرژی فرمی را بر اساس چگالی عددی الکترونهای رسانش ![]() محاسبه کنیم.
محاسبه کنیم.
مثال کاربردی از محاسبه انرژی فرمی
فرض کنید چگالی عددی الکترونهای رسانش در یک فلز خاص برابر با ![]() است. برای محاسبه انرژی فرمی این فلز از رابطه فوق استفاده میکنیم. با قرار دادن مقادیر ثابتها و چگالی عددی الکترونها در رابطه، میتوان مقدار انرژی فرمی را به دست آورد.
است. برای محاسبه انرژی فرمی این فلز از رابطه فوق استفاده میکنیم. با قرار دادن مقادیر ثابتها و چگالی عددی الکترونها در رابطه، میتوان مقدار انرژی فرمی را به دست آورد.
نتیجهگیری و سؤالات برای تفکر بیشتر
در این مقاله به بررسی مفاهیم کلیدی مرتبط با الکترونهای رسانش، انرژی فرمی، و چگالی حالتها در فلزات پرداختیم. این مفاهیم اساس درک رفتار فلزات از نظر رسانایی الکتریکی و حرارتی هستند. برای درک بهتر این مفاهیم، پیشنهاد میشود به سؤالات زیر فکر کنید:
- چرا فلزات در دماهای پایین رسانایی بهتری دارند؟
- چگونه تغییر تعداد الکترونهای رسانش در یک فلز میتواند بر ویژگیهای الکتریکی آن تأثیر بگذارد؟
- چگونه میتوان با تغییر دما، احتمال اشغال یک حالت انرژی خاص را تحت تأثیر قرار داد؟
این سؤالات به شما کمک میکنند تا درک عمیقتری از رفتار فلزات به دست آورید و اصول فیزیکی پشت این رفتارها را بهتر بشناسید.
