گرمای ویژه مولی
مفهوم گرمای ویژه مولی در فیزیک
گرمای ویژه مولی یک مفهوم کلیدی در فیزیک و شیمی است که به بررسی نحوه تغییرات دما و انرژی در گازها و مواد میپردازد. این موضوع، بهویژه در مطالعات مربوط به گازهای ایدهآل و واقعی، اهمیت دارد و از مفاهیمی است که در ترمودینامیک، دینامیک گازها و بسیاری از رشتههای دیگر نقش کلیدی دارد. در این مقاله، ما به طور جامع و ساده به مفهوم گرمای ویژه مولی، فرمولها، اصول و مثالهای مختلف خواهیم پرداخت تا این موضوع بهخوبی برای همه قابل فهم باشد.
تعریف گرمای ویژه مولی
گرمای ویژه مولی به مقدار گرمای لازم برای افزایش دمای یک مول از ماده به اندازه یک کلوین (1 K) گفته میشود. این مفهوم با استفاده از واحدهای انرژی و دما بیان میشود و به دو نوع تقسیم میشود: گرمای ویژه مولی در حجم ثابت و گرمای ویژه مولی در فشار ثابت.
گرمای ویژه مولی در حجم ثابت (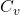 )
)
گرمای ویژه مولی در حجم ثابت (![]() ) به مقدار گرمای لازم برای افزایش دمای یک مول از گاز در حالتی که حجم آن ثابت باشد، اشاره دارد. فرمول آن به صورت زیر بیان میشود:
) به مقدار گرمای لازم برای افزایش دمای یک مول از گاز در حالتی که حجم آن ثابت باشد، اشاره دارد. فرمول آن به صورت زیر بیان میشود:
![]()
در این فرمول:
![]() مقدار گرمای اضافه شده به گاز است.
مقدار گرمای اضافه شده به گاز است.
![]() تعداد مولهای گاز است.
تعداد مولهای گاز است.
![]() تغییر دما است.
تغییر دما است.
![]() تغییر در انرژی داخلی گاز است.
تغییر در انرژی داخلی گاز است.
برای یک گاز ایدهآل تکاتمی، گرمای ویژه مولی در حجم ثابت به صورت زیر بیان میشود:
![]()
که در اینجا:
![]() ثابت گازها (حدود 8.314 ژول بر مول بر کلوین) است.
ثابت گازها (حدود 8.314 ژول بر مول بر کلوین) است.
در این حالت، مقدار ![]() برای یک گاز ایدهآل تکاتمی برابر با 12.5 ژول بر مول بر کلوین است.
برای یک گاز ایدهآل تکاتمی برابر با 12.5 ژول بر مول بر کلوین است.
گرمای ویژه مولی در فشار ثابت (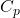 )
)
در مقابل، گرمای ویژه مولی در فشار ثابت (![]() ) به مقدار گرمای لازم برای افزایش دمای یک مول از گاز در حالی که فشار ثابت است، اشاره دارد. فرمول آن به صورت زیر است:
) به مقدار گرمای لازم برای افزایش دمای یک مول از گاز در حالی که فشار ثابت است، اشاره دارد. فرمول آن به صورت زیر است:
![]()
در این فرمول نیز ![]() ،
، ![]() و
و ![]() همان تعاریف قبلی را دارند. همچنین، طبق رابطه زیر،
همان تعاریف قبلی را دارند. همچنین، طبق رابطه زیر، ![]() و
و ![]() با یکدیگر مرتبط هستند:
با یکدیگر مرتبط هستند:
![]()
یعنی گرمای ویژه مولی در فشار ثابت همیشه مقداری بیشتر از گرمای ویژه مولی در حجم ثابت است، زیرا در فشار ثابت گاز باید علاوه بر افزایش دما، کار بر محیط نیز انجام دهد.
اصول و مبانی گرمای ویژه مولی
مفهوم گرمای ویژه مولی از اصول بنیادی ترمودینامیک نشأت میگیرد. در این بخش، ما به اصول پایهای که این مفاهیم را تعریف میکنند، نگاهی میاندازیم.
انرژی داخلی گاز ایدهآل
برای یک گاز ایدهآل، انرژی داخلی تنها به دمای گاز بستگی دارد و با استفاده از رابطه زیر تعریف میشود:
![]()
در این رابطه:
![]() انرژی داخلی گاز است.
انرژی داخلی گاز است.
![]() دمای گاز است.
دمای گاز است.
این رابطه بیانگر این است که افزایش دما به معنای افزایش انرژی داخلی گاز است و مقدار آن به تعداد مولهای گاز و گرمای ویژه مولی در حجم ثابت بستگی دارد.
تغییرات انرژی داخلی گاز
هنگامی که یک گاز ایدهآل در یک فرایند حرارتی دچار تغییر دما شود، تغییرات انرژی داخلی آن از رابطه زیر پیروی میکند:
![]()
این معادله به ما نشان میدهد که هرگاه دمای گاز تغییر کند (افزایش یا کاهش یابد)، انرژی داخلی آن نیز به تناسب تغییر خواهد کرد.
مثال کاربردی: تغییر دمای گاز ایدهآل
فرض کنید ما 2 مول از یک گاز ایدهآل تکاتمی داریم که از دمای 300 کلوین به 400 کلوین گرم میشود. برای محاسبه تغییر در انرژی داخلی این گاز، از فرمول زیر استفاده میکنیم:
![]()
با جایگذاری مقادیر:
![]() مول
مول
![]() ژول بر مول بر کلوین
ژول بر مول بر کلوین
![]() کلوین
کلوین
داریم:
![]()
بنابراین، تغییر در انرژی داخلی گاز برابر با 2500 ژول خواهد بود.
گرمای ویژه مولی در گازهای واقعی
در گازهای واقعی، گرمای ویژه مولی ممکن است به شرایط دما و فشار وابسته باشد. در دماهای بالا یا فشارهای بسیار زیاد، رفتار گازها از حالت ایدهآل فاصله میگیرد و گرمای ویژه مولی آنها نیز تغییر میکند. در این شرایط، باید از مدلهای پیچیدهتری برای محاسبه ![]() و
و ![]() استفاده کرد.
استفاده کرد.
مقایسه گازهای تکاتمی و چنداتمی
گازهای تکاتمی مانند هلیوم و نئون دارای مقدار ![]() کمتری نسبت به گازهای چنداتمی هستند. دلیل این امر این است که در گازهای چنداتمی، مولکولها میتوانند در جهتهای مختلف چرخش و ارتعاش کنند، که باعث افزایش ظرفیت گرمایی میشود. در گازهای چنداتمی،
کمتری نسبت به گازهای چنداتمی هستند. دلیل این امر این است که در گازهای چنداتمی، مولکولها میتوانند در جهتهای مختلف چرخش و ارتعاش کنند، که باعث افزایش ظرفیت گرمایی میشود. در گازهای چنداتمی، ![]() میتواند به مقدارهای بزرگتری برسد و به فرمولهای پیچیدهتری نیاز باشد.
میتواند به مقدارهای بزرگتری برسد و به فرمولهای پیچیدهتری نیاز باشد.
سؤالات تفکری
- چرا در گازهای چنداتمی گرمای ویژه مولی بیشتر از گازهای تک\–اتمی است؟
- اگر مقدار
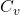 برای یک گاز ایدهآل 12.5 ژول بر مول بر کلوین است، مقدار
برای یک گاز ایدهآل 12.5 ژول بر مول بر کلوین است، مقدار 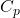 چقدر خواهد بود؟
چقدر خواهد بود؟ - چگونه میتوان تغییرات انرژی داخلی یک گاز را در فرآیندهایی که حجم آن تغییر میکند، محاسبه کرد؟
- در چه شرایطی رفتار یک گاز واقعی از حالت ایدهآل فاصله میگیرد و چگونه میتوان گرمای ویژه مولی آن را در این شرایط محاسبه کرد؟
نتیجهگیری
گرمای ویژه مولی یک مفهوم کلیدی در مطالعه خواص حرارتی گازهاست که به طور گستردهای در فیزیک و شیمی کاربرد دارد. این مفهوم به ما کمک میکند تا درک بهتری از تغییرات انرژی و دما در سیستمهای گازی داشته باشیم. گرمای ویژه مولی در حجم ثابت و فشار ثابت به ترتیب بیانگر مقدار گرمای لازم برای افزایش دمای یک مول گاز در شرایط خاص هستند. از این اصول میتوان برای محاسبه تغییرات انرژی داخلی، کار انجام شده توسط گاز و بسیاری دیگر از پدیدههای مرتبط با گازها استفاده کرد.
تسلط بر این مفهوم به شما این امکان را میدهد که در موضوعاتی چون ترمودینامیک و دینامیک گازها به درک عمیقتری دست یابید و بتوانید به سوالات اساسی در مورد نحوه رفتار گازها در شرایط مختلف پاسخ دهید.
