عدد آووگادرو
عدد آووگادرو: کلید فهم مول در شیمی و فیزیک
عدد آووگادرو (Avogadro’s Number) یکی از مهمترین مفاهیم در علوم شیمی و فیزیک است که به ما کمک میکند تعداد ذراتی را که در یک مقدار معین از ماده وجود دارد، درک کنیم. این مفهوم درک ما از مولکولها و اتمها را به سطح جدیدی میبرد و در تمامی مباحثی که با اندازهگیریهای مولکولی و اتمی سروکار دارند، مورد استفاده قرار میگیرد. در این مقاله قصد داریم به شکلی ساده و قابل فهم به تعریف و توضیح کامل عدد آووگادرو، مفهوم مول، و رابطه بین جرم مولار و تعداد ذرات بپردازیم. همچنین با مثالهای متنوع و کاربردی سعی خواهیم کرد تا این موضوع برای همه مخاطبان قابل درک باشد.
عدد آووگادرو چیست؟
عدد آووگادرو، که به صورت ![]() نشان داده میشود، مقدار ثابتی است که تعداد ذرات (اتمها، مولکولها، یا یونها) موجود در یک مول از ماده را نشان میدهد. مقدار عدد آووگادرو به صورت تجربی برابر با:
نشان داده میشود، مقدار ثابتی است که تعداد ذرات (اتمها، مولکولها، یا یونها) موجود در یک مول از ماده را نشان میدهد. مقدار عدد آووگادرو به صورت تجربی برابر با:
![]()
است. این عدد بسیار بزرگ است و به ما کمک میکند تا بتوانیم تعداد ذرات موجود در مقادیر ماکروسکوپیک مواد را محاسبه کنیم. به بیان ساده، اگر شما یک مول از هر مادهای را داشته باشید، تعداد ذرات آن ماده برابر با عدد آووگادرو است.
چرا این عدد اهمیت دارد؟
عدد آووگادرو به ما امکان میدهد که به جای کار کردن با اعداد بسیار بزرگ و پیچیدهای که نشان دهنده تعداد واقعی مولکولها یا اتمها است، از واحدی به نام مول استفاده کنیم. این واحد در اندازهگیریهای شیمی و فیزیک بهطور گستردهای کاربرد دارد.
مفهوم مول (Mole) چیست؟
مول (Mole) یک واحد اندازهگیری در سیستم SI است که برای بیان تعداد ذرات موجود در یک ماده استفاده میشود. یک مول از هر مادهای شامل ![]() (عدد آووگادرو) ذره است.
(عدد آووگادرو) ذره است.
به طور خلاصه، یک مول ماده برابر است با:
![]()
این ذرهها میتوانند اتم، مولکول، یا یون باشند. بنابراین، با داشتن یک مول از هر مادهای، تعداد دقیق این ذرات را میدانیم.
چرا از مول استفاده میکنیم؟
چرا به جای استفاده از تعداد واقعی مولکولها یا اتمها، از مول استفاده میکنیم؟ پاسخ ساده است: تعداد ذرات در مواد حتی در مقادیر کوچک بسیار زیاد است. برای مثال، در یک لیوان آب بیش از 102310^{23} مولکول آب وجود دارد. محاسبه مستقیم این اعداد بسیار دشوار و غیرعملی است. اما با استفاده از مول، میتوانیم به راحتی تعداد ذرات در مقادیر مختلف از مواد را محاسبه کنیم.
فرمول های کلیدی مرتبط با عدد آووگادرو
حال که با مفهوم عدد آووگادرو و مول آشنا شدیم، به بررسی فرمولهای مهم و مرتبط با آن میپردازیم. این فرمولها به ما کمک میکنند تا محاسبات لازم را برای تعیین تعداد ذرات، جرم مولار، و تعداد مولکولها در نمونههای مختلف انجام دهیم.
۱. جرم مولار (Molar Mass)
جرم مولار (![]() ) جرم یک مول از یک ماده است. به عبارت دیگر، جرم مولار به ما میگوید که یک مول از یک ماده چقدر جرم دارد. رابطه بین جرم مولکول (
) جرم یک مول از یک ماده است. به عبارت دیگر، جرم مولار به ما میگوید که یک مول از یک ماده چقدر جرم دارد. رابطه بین جرم مولکول (![]() ) و جرم مولار به صورت زیر است:
) و جرم مولار به صورت زیر است:
![]()
در اینجا:
![]() جرم مولار ماده است.
جرم مولار ماده است.
![]() جرم یک مولکول منفرد است.
جرم یک مولکول منفرد است.
![]() عدد آووگادرو است.
عدد آووگادرو است.
این فرمول نشان میدهد که جرم مولار یک ماده برابر است با جرم هر مولکول آن ماده ضرب در عدد آووگادرو.
۲. تعداد مول (
(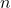 )
)
تعداد مول![]() (
(![]() ) در نمونهای از یک ماده را میتوان به چندین روش مختلف محاسبه کرد. یکی از مهمترین فرمول
) در نمونهای از یک ماده را میتوان به چندین روش مختلف محاسبه کرد. یکی از مهمترین فرمول![]() برای محاسبه تعداد مول
برای محاسبه تعداد مول![]() به صورت زیر است:
به صورت زیر است:
![]()
که در آن:
![]() تعداد مول
تعداد مول![]() است.
است.
![]() جرم نمونه ماده است.
جرم نمونه ماده است.
![]() جرم مولار ماده است.
جرم مولار ماده است.
با استفاده از این فرمول، میتوانیم تعداد مول![]() را از جرم نمونهای از ماده محاسبه کنیم.
را از جرم نمونهای از ماده محاسبه کنیم.
۳. رابطه بین تعداد مولکول و تعداد مول
و تعداد مول
اگر تعداد مولکول![]() ی موجود در یک نمونه را بدانیم، میتوانیم تعداد مول
ی موجود در یک نمونه را بدانیم، میتوانیم تعداد مول![]() را با استفاده از عدد آووگادرو به دست آوریم:
را با استفاده از عدد آووگادرو به دست آوریم:
![]()
که در آن:
![]() تعداد مولکول
تعداد مولکول![]() است.
است.
![]() عدد آووگادرو است.
عدد آووگادرو است.
![]() تعداد مول
تعداد مول![]() است.
است.
این رابطه نشان میدهد که تعداد مول![]() برابر است با تعداد مولکول
برابر است با تعداد مولکول![]() تقسیم بر عدد آووگادرو.
تقسیم بر عدد آووگادرو.
مثالهای عملی برای درک بهتر
برای درک بهتر مفاهیم بالا، چند مثال را با هم بررسی میکنیم.
مثال ۱: محاسبه جرم مولار آب
همانطور که میدانید، فرمول شیمیایی آب ![]() است. جرم مولی هر عنصر را میتوان از جدول تناوبی استخراج کرد:
است. جرم مولی هر عنصر را میتوان از جدول تناوبی استخراج کرد:
جرم مولی هیدروژن (![]() ) تقریباً
) تقریباً ![]() است.
است.
جرم مولی اکسیژن (![]() ) تقریباً
) تقریباً ![]() است.
است.
برای محاسبه جرم مولار آب، از فرمول زیر استفاده میکنیم:
![]()
بنابراین، جرم مولار آب ![]() است.
است.
مثال ۲: محاسبه تعداد مولها در 36 گرم آب
با توجه به اینکه جرم مولار آب ![]() است، میخواهیم تعداد مولهای آب را در یک نمونه
است، میخواهیم تعداد مولهای آب را در یک نمونه ![]() محاسبه کنیم. از فرمول زیر استفاده میکنیم:
محاسبه کنیم. از فرمول زیر استفاده میکنیم:
![]()
که در آن:
![]() است.
است.
![]() است.
است.
با قرار دادن مقادیر در فرمول:
![]()
بنابراین، در ![]() آب،
آب، ![]() آب وجود دارد.
آب وجود دارد.
مثال ۳: محاسبه تعداد مولکولهای موجود در 2 مول آب
برای محاسبه تعداد مولکولهای موجود در ![]() آب، از فرمول زیر استفاده میکنیم:
آب، از فرمول زیر استفاده میکنیم:
![]()
با جایگذاری مقادیر:
![]()
بنابراین، در ![]() آب، حدود
آب، حدود ![]() مولکول وجود دارد.
مولکول وجود دارد.
عدد آووگادرو و کاربردهای آن در زندگی روزمره
عدد آووگادرو نه تنها در محاسبات علمی و تجربی مفید است، بلکه به ما در درک پدیدههای روزمره نیز کمک میکند. به عنوان مثال، وقتی میگوییم که در یک مول ماده تقریباً ![]() ذره وجود دارد، میتوانیم تصور کنیم که چگونه ذرات بسیار کوچک در مقیاسهای بزرگ ماده تأثیر میگذارند.
ذره وجود دارد، میتوانیم تصور کنیم که چگونه ذرات بسیار کوچک در مقیاسهای بزرگ ماده تأثیر میگذارند.
چرا این عدد بزرگ اهمیت دارد؟
با توجه به عدد آووگادرو، متوجه میشویم که چگونه حتی مقادیر کوچک از مادهها حاوی تعداد بسیار زیادی از ذرات هستند. این به ما نشان میدهد که واکنشهای شیمیایی و فیزیکی که در مقیاس مولکولی رخ میدهند، چگونه میتوانند اثرات ماکروسکوپیک بزرگی ایجاد کنند.
