گاز ایده آل
مفهوم گاز ایدهآل در علم فیزیک: قانون گازهای ایدهآل
در دنیای فیزیک، گازها رفتارهای متنوعی از خود نشان میدهند که توسط قوانین مختلف توصیف میشوند. یکی از مهمترین این قوانین، قانون گازهای ایدهآل است. در این مقاله به طور جامع و ساده به مفهوم گاز ایدهآل، اصول و فرمولهای آن میپردازیم، و مثالهایی از زندگی روزمره و کاربردهای علمی این مفهوم ارائه میدهیم تا فهم آن برای عموم و متخصصان آسان باشد.
گاز ایدهآل چیست؟
گاز ایدهآل مدلی از گاز است که در آن ذرات گاز با یکدیگر و با دیوارههای ظرف برخوردهای کاملاً الاستیک دارند و نیروی میانذرهای قابلتوجهی میان آنها وجود ندارد. این مدل سادهسازی شده است، اما در بسیاری از شرایط، رفتار واقعی گازها را به خوبی توصیف میکند. رابطهای که برای توصیف گازهای ایدهآل استفاده میشود، به قانون گاز ایدهآل معروف است:
![]()
در اینجا:
![]() فشار گاز است (به پاسکال).
فشار گاز است (به پاسکال).
![]() حجم گاز است (به لیتر یا متر مکعب).
حجم گاز است (به لیتر یا متر مکعب).
![]() تعداد مول\u200cهای گاز است.
تعداد مول\u200cهای گاز است.
![]() ثابت گازهاست (8.31 ژول بر مول کلوین).
ثابت گازهاست (8.31 ژول بر مول کلوین).
![]() دمای مطلق گاز است (به کلوین).
دمای مطلق گاز است (به کلوین).
اصول قانون گاز ایدهآل
قانون گازهای ایدهآل بیان میکند که بین فشار، حجم و دمای یک گاز رابطه مستقیمی وجود دارد. این قانون تنها برای گازهایی که در دما و فشار معقول قرار دارند، معتبر است. برای گازهایی که به نقطه چگالش نزدیک میشوند، این قانون ممکن است دقت کافی نداشته باشد.
به منظور درک بهتر این قانون، بیایید آن را تجزیه کنیم:
فشار 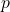
فشار به معنای نیرویی است که توسط مولکولهای گاز به دیوارههای ظرف وارد میشود. هرچه مولکولهای گاز بیشتر و با سرعت بیشتری با دیوارهها برخورد کنند، فشار بیشتری تولید میشود.
حجم 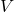
حجم ظرفی که گاز در آن قرار دارد نیز بر رفتار گاز تأثیر میگذارد. حجم بیشتر به معنای فضای بیشتری برای حرکت مولکولهاست، که میتواند منجر به کاهش برخوردها و در نتیجه کاهش فشار شود.
دما 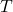
دمای گاز نشاندهنده میانگین انرژی جنبشی مولکولهاست. وقتی دما افزایش مییابد، مولکولها سریعتر حرکت میکنند و به دیوارهها برخورد میکنند که این افزایش برخوردها منجر به افزایش فشار میشود.
تعداد مول 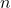
تعداد مولهای گاز نیز عاملی مهم در این معادله است. هر مول گاز شامل تعداد مشخصی مولکول است که با ثابت آووگادرو مشخص میشود. هرچه تعداد مولهای گاز بیشتر باشد، برخوردهای بیشتری با دیوارهها انجام میشود که منجر به افزایش فشار خواهد شد.
ثابت گازها 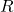
ثابت گازها مقداری ثابت است که در تمامی محاسبات مربوط به گازهای ایدهآل مورد استفاده قرار میگیرد و مقدار آن 8.31 ژول بر مول کلوین است.
فرمول جایگزین: استفاده از ثابت بولتزمن
قانون گازهای ایدهآل را میتوان به شکلی دیگر نیز بیان کرد:
![]()
در اینجا:
![]() تعداد ذرات (مولکولهای) گاز است.
تعداد ذرات (مولکولهای) گاز است.
![]() ثابت بولتزمن است (
ثابت بولتزمن است (![]() ژول بر کلوین).
ژول بر کلوین).
این فرم معادله زمانی کاربردی است که به جای مول گاز، تعداد ذرات گاز مدنظر باشد. ثابت بولتزمن رابطهای بین انرژی جنبشی مولکولهای گاز و دمای آنها برقرار میکند.
مثالها از زندگی روزمره
باد کردن یک توپ
تصور کنید که یک توپ ورزشی را با هوا پر میکنید. همانطور که هوا را به داخل توپ وارد میکنید، تعداد مولهای گاز (هوا) درون توپ افزایش مییابد. طبق قانون گازهای ایدهآل، با افزایش تعداد مولهای گاز، فشار داخل توپ نیز افزایش پیدا میکند. همچنین، اگر توپ در محیط گرمتری قرار گیرد (افزایش دما)، فشار داخلی توپ باز هم افزایش مییابد.
بادکنک و تغییر دما
یک بادکنک را در نظر بگیرید. وقتی بادکنک را از یک اتاق گرم به یک اتاق سرد منتقل میکنید، دمای گاز داخل بادکنک کاهش مییابد. با کاهش دما، انرژی جنبشی مولکولهای هوا کاهش پیدا میکند و مولکولها با شدت کمتری به دیوارههای بادکنک برخورد میکنند. نتیجه آن کاهش فشار و کوچک شدن بادکنک است.
تایر خودرو
در تایرهای خودرو نیز همین اصل عمل میکند. وقتی تایر گرم میشود (به دلیل اصطکاک با جاده)، دمای گاز داخل تایر بالا میرود و فشار نیز افزایش پیدا میکند. بنابراین در روزهای گرم، ممکن است فشار تایر بیشتر از حد معمول باشد و به طور مشابه در هوای سرد، فشار کاهش یابد.
کاربردهای علمی و صنعتی قانون گازهای ایدهآل
قانون گازهای ایدهآل در بسیاری از کاربردهای علمی و صنعتی مورد استفاده قرار میگیرد. برخی از این کاربردها عبارتند از:
-
سیستمهای تهویه و گرمایش: طراحی سیستمهای تهویه مطبوع و گرمایش ساختمانها بر اساس این قانون انجام میشود تا فشار و دمای هوا درون محیط کنترل شود.
-
طراحی موتورهای احتراق داخلی: در موتورهای خودرو و هواپیما، بررسی فشار و حجم گازها اهمیت ویژهای دارد و از این قانون برای بهینهسازی عملکرد موتور استفاده میشود.
-
صنعت گاز و نفت: در فرآیندهای مربوط به انتقال و ذخیره گازهای صنعتی مانند اکسیژن و نیتروژن، از قانون گازهای ایدهآل برای محاسبه فشار و حجم استفاده میشود.
محدودیتهای قانون گاز ایدهآل
اگرچه قانون گازهای ایدهآل در بسیاری از شرایط عملکرد خوبی دارد، اما در برخی موارد از جمله:
- دمای بسیار پایین: در دماهای نزدیک به صفر مطلق، مولکولهای گاز عملاً حرکت نمیکنند و گاز رفتارهایی شبیه به مایعات نشان میدهد.
- فشار بسیار بالا: در فشارهای بالا، مولکولهای گاز بسیار نزدیک به هم میشوند و برهمکنشهای میانمولکولی نمیتوانند نادیده گرفته شوند.
سؤالاتی برای تفکر بیشتر
- اگر مقدار گاز در یک ظرف افزایش یابد اما حجم ثابت بماند، چه اتفاقی برای فشار میافتد؟ دلیل خود را توضیح دهید.
- اگر دمای یک گاز ایدهآل را دو برابر کنیم، فشار آن چگونه تغییر خواهد کرد؟
- آیا میتوان از قانون گازهای ایدهآل برای گازهای سنگین مانند بخار آب استفاده کرد؟ چرا یا چرا نه؟
- اگر یک بادکنک پر از هلیوم را به فضای بیرون از زمین بفرستیم، چه اتفاقی برای حجم بادکنک خواهد افتاد؟ چرا؟
نتیجهگیری
قانون گازهای ایدهآل یکی از اصول بنیادی فیزیک است که رابطهای ساده و مهم میان فشار، حجم و دمای گازها ارائه میدهد. این قانون درک بهتری از رفتار گازها در شرایط مختلف به ما میدهد و در زندگی روزمره و صنایع مختلف کاربرد دارد. با وجود محدودیتهای این قانون در شرایط خاص، همچنان یکی از ابزارهای قدرتمند در فیزیک و شیمی برای تحلیل و پیشبینی رفتار گازهاست.
