فرآیند بی دررو
مفهوم فرآیند بیدررو (Adiabatic Process) در فیزیک
یکی از مهمترین مفاهیم در ترمودینامیک و فیزیک گازها، فرآیند بیدررو (Adiabatic Process) است. این مفهوم برای دانشآموزان، دانشجویان و علاقهمندان به فیزیک پایهای، اهمیت بالایی دارد؛ زیرا به درک رفتار گازها و ارتباط میان فشار، حجم و دما کمک میکند. در این مقاله سعی میکنیم با استفاده از زبان ساده، مفاهیم کلیدی را توضیح داده و با مثالها و فرمولها این موضوع را بررسی کنیم.
فرآیند بیدررو چیست؟
فرآیند بیدررو (Adiabatic) فرآیندی است که در آن هیچ تبادل گرمایی بین سیستم و محیط اطراف آن صورت نمیگیرد. به عبارت دیگر، در این فرآیند مقدار گرما (Q) برابر با صفر است. این بدان معناست که تمام تغییرات درونی سیستم فقط از طریق کار (مثلاً تغییر حجم یا فشار) انجام میگیرد.
چرا فرآیند بیدررو مهم است؟
فرآیندهای بیدررو در بسیاری از سیستمهای طبیعی و مهندسی اهمیت دارند. به عنوان مثال، در سیستمهای بسته که نمیتوانند با محیط اطراف خود تبادل گرمایی کنند، تغییرات فیزیکی از طریق فرآیندهای بیدررو انجام میشود. همچنین، در برخی از ماشینهای حرارتی مانند موتورهای بنزینی یا دیزلی، برخی از مراحل تغییرات انرژی به صورت بیدررو است.
ویژگیهای فرآیند بیدررو
برای درک بهتر فرآیند بیدررو، باید به برخی ویژگیها و اصول اساسی آن توجه کنیم:
1. شرط اصلی فرآیند بیدررو: 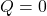
مهمترین ویژگی فرآیند بیدررو این است که تبادل گرما با محیط وجود ندارد. در این حالت، گرما صفر است ![]() . این یعنی هر تغییری در انرژی داخلی سیستم ناشی از کار انجام\-شده روی سیستم یا توسط سیستم است.
. این یعنی هر تغییری در انرژی داخلی سیستم ناشی از کار انجام\-شده روی سیستم یا توسط سیستم است.
2. ارتباط بین فشار، حجم و دما
در فرآیند بیدررو، رابطه بین فشار ![]() ، حجم
، حجم ![]() و دما
و دما ![]() پیچیده است. یکی از مهمترین معادلات مربوط به فرآیند بیدررو به صورت زیر است:
پیچیده است. یکی از مهمترین معادلات مربوط به فرآیند بیدررو به صورت زیر است:
![]()
در این معادله، ![]() (گاما) نسبت گرمای ویژه
(گاما) نسبت گرمای ویژه ![]() است. این نسبت برای هر گاز متفاوت است و به ویژگیهای مولکولی آن بستگی دارد.
است. این نسبت برای هر گاز متفاوت است و به ویژگیهای مولکولی آن بستگی دارد.
فرمولها و اصول مهم در فرآیند بیدررو
برای فهم بهتر فرآیند بیدررو، باید به برخی از معادلات و فرمولهای اساسی آن اشاره کنیم. این فرمولها به ما کمک میکنند که رفتار گازها را در این فرآیند بهتر درک کنیم.
1. قانون اساسی فرآیند بیدررو: 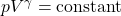
این معادله نشاندهنده رابطه بین فشار و حجم در یک فرآیند بیدررو است. یعنی وقتی حجم یک گاز تغییر میکند (کاهش یا افزایش)، فشار نیز تغییر میکند تا محصول فشار و حجم به توان ![]() ثابت بماند.
ثابت بماند.
مثال:
فرض کنید یک گاز ایدهآل در دمای 300 کلوین و فشار 1 اتمسفر قرار دارد و حجم آن به نصف کاهش مییابد. با استفاده از معادله بیدررو میتوانیم فشار نهایی گاز را محاسبه کنیم.
2. تغییرات دما در فرآیند بیدررو
در فرآیند بیدررو، دما نیز تغییر میکند. اگر حجم گاز کاهش یابد، دمای آن افزایش مییابد و اگر حجم افزایش یابد، دما کاهش مییابد. این تغییرات به دلیل انجام کار روی سیستم (یا توسط سیستم) بدون تبادل گرما با محیط رخ میدهد.
![]()
این معادله نیز رابطهای بین دما و حجم در فرآیند بیدررو نشان میدهد.
مثالهایی از فرآیند بیدررو در دنیای واقعی
برای اینکه بهتر متوجه شویم که فرآیند بیدررو در کجاها مشاهده میشود، به چند مثال واقعی از این فرآیند در زندگی روزمره و سیستمهای مختلف اشاره میکنیم.
1. فشردهسازی هوا در سیلندر موتور خودرو
یکی از بارزترین مثالهای فرآیند بیدررو، فشردهسازی هوا در سیلندر موتور خودرو است. هنگامی که پیستون در موتور خودرو به سمت بالا حرکت میکند و حجم سیلندر را کاهش میدهد، هوا در داخل سیلندر فشرده میشود و دمای آن افزایش مییابد. این تغییر به دلیل این است که هیچ تبادل گرمایی با محیط بیرون وجود ندارد و تمام انرژی به شکل کار فشردهسازی روی گاز صرف میشود.
2. دمای هوا در کوهها
هنگامی که یک توده هوای گرم از سطح دریا به ارتفاعات بالاتر صعود میکند، حجم آن افزایش مییابد و دمای آن کاهش پیدا میکند. این فرآیند تقریباً به صورت بیدررو انجام میشود، زیرا تبادل گرمایی کمی بین هوا و محیط اطراف آن وجود دارد. این مسئله توضیح میدهد که چرا در کوهها هوا سردتر از سطح زمین است.
سوالاتی برای درک بیشتر
برای اینکه خواننده بهتر با مفاهیم فرآیند بیدررو آشنا شود و تعامل بیشتری با موضوع داشته باشد، میتوان سوالاتی مطرح کرد:
- اگر یک گاز ایدهآل در فرآیند بیدررو فشرده شود، چه تغییری در دمای آن رخ خواهد داد؟ چرا؟
- چگونه میتوان رابطه بین فشار و حجم را در فرآیند بیدررو محاسبه کرد؟
- چه مثالهای دیگری از فرآیند بیدررو میتوانید در زندگی روزمره پیدا کنید؟
تفاوت فرآیند بیدررو و فرآیندهای دیگر
فرآیندهای ترمودینامیکی مختلفی وجود دارند که هرکدام ویژگیهای خاص خود را دارند. یکی از سوالات رایج این است که فرآیند بیدررو چه تفاوتی با سایر فرآیندهای ترمودینامیکی دارد؟
1. فرآیند همدما (Isothermal)
در فرآیند همدما، دمای سیستم ثابت میماند و تبادل گرمایی بین سیستم و محیط وجود دارد. در حالی که در فرآیند بیدررو، هیچ تبادل گرمایی وجود ندارد و دما تغییر میکند.
2. فرآیند همفشار (Isobaric)
در فرآیند همفشار، فشار سیستم ثابت میماند و حجم و دما تغییر میکنند. اما در فرآیند بیدررو، فشار و حجم تغییر میکنند و هیچ تبادل گرمایی وجود ندارد.
3. فرآیند همحجم (Isochoric)
در فرآیند همحجم، حجم ثابت میماند و فشار و دما تغییر میکنند. در حالی که در فرآیند بیدررو، حجم و فشار هردو تغییر میکنند.
جمعبندی
فرآیند بیدررو یکی از مفاهیم اساسی در فیزیک و ترمودینامیک است که در آن هیچ تبادل گرمایی با محیط صورت نمیگیرد و تغییرات انرژی داخلی سیستم به واسطه کار انجامشده روی آن است. این فرآیند در بسیاری از سیستمهای طبیعی و صنعتی رخ میدهد و درک آن میتواند به ما در تحلیل رفتار گازها و سیستمهای مختلف کمک کند. با مطالعه این مقاله و توجه به سوالات مطرحشده، میتوانید این مفهوم را بهتر درک کرده و در شرایط مختلف به کار ببرید.
